中性子捕捉療法とは
1. 原理
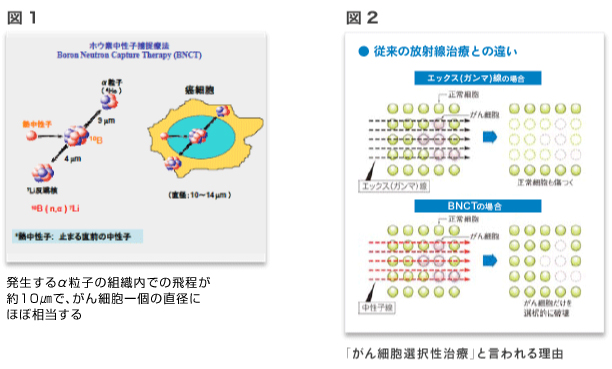
ホウ素中性子捕捉療法(Boron Neutron capture therapy:以下BNCT)は、ホウ素(10B)と熱中性子との核反応で生じる線エネルギー付与(Linear Energy Transfer: LET)の高い放射線であるα粒子とリチウム原子核を用いてがん細胞のみを破壊する放射線治療である。 発生するα粒子及びリチウム原子核の組織内での飛程がそれぞれ約9及び4μmで、がん細胞一個の直径にほぼ相当することから、がん細胞に特異的に集積するホウ素化合物を用い、同部位に熱中性子線を照射すればがん細胞のみにエネルギ-を集中して殺傷するがん細胞選択的治療が可能となる(図1)。
核反応というとどうしても核爆弾のイメ-ジがあり、その影響(エネルギ-)は何Kmにも及ぶと思ってしまいがちだが、上で述べたホウ素と熱中性子の核反応で発生するα粒子のエネルギ-は約10μmすなわちがん細胞1個の直径と同等の距離までしか及ばない。
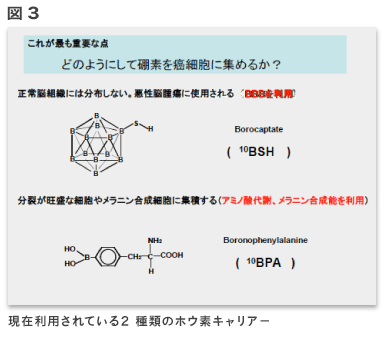
そのためがん細胞にのみホウ素が取り込まれ、周囲の正常細胞がホウ素を取り込まれなければ、熱中性子照射によりホウ素が存在するがん細胞のところでのみ核反応が生じ、その影響は隣の正常細胞には届かないことになる。がん細胞の中だけですべてのイベントは完結する。このような理由でBNCTは「がん細胞選択性治療」とも言われる(図2)。
2. 歴史的背景と現状
BNCTの原理は米国で開発され、1960年代の初めに悪性脳腫瘍のBNCT臨床試験が行われたが、熱中性子の質が良くなかった事(速中性子線およびガンマ線の混入比が大)、使用したホウ素化合物が適切でなかったことなどにより正常脳への傷害が強く失敗に終わっている。原理的には優れた治療法であるが、これを一般的治療として実現するには多くの物理工学的、生物学的課題を解決しなければならなかった。
一方わが国においては畠中、三嶋らの先駆的努力により脳腫瘍および悪性黒色腫のBNCTの臨床試験が開始され、現在までに脳腫瘍400例以上、悪性黒色腫においては30例以上、頭頸部がんでは130例以上の治療症例が蓄積されている。米国では日本の治療成果に刺激されて1994年に臨床治療研究が再開され、それに触発されたEU諸国でも研究用原子炉を有するオランダ、フィンランドを中心に次々と臨床治療研究が開始された。
その後スウェーデン、チェコ、アルゼンチン、イタリア、台湾なども研究を開始している。本治療は日本が主導的立場に立ち世界に発信している最先端がん治療法である。2010年には、世界初のBNCT用加速器が住友重機械工業(株)と京都大学の共同研究により開発され、原子炉にたよることなく中性子が得られるようになった。
2012年9月には、第15回国際癌中性子捕捉療法学会(大会長:松村明 筑波大学・脳神経外科教授)が筑波で開催され、米国、EU諸国、オ-ストラリアをはじめアルゼンチン、中国、韓国、台湾からの研究者も多数参加し加速器BNCTの臨床応用に向かって活発な発表がなされた。
また、同年12月からは、脳腫瘍に対して加速器BNCTの第1相臨床試験が開始され、2014年には、頭頸部がんに対して加速器BNCTの第1相臨床試験が開始された。次いで2016年に開始された脳腫瘍ならびに頭頸部がんに対する第2相臨床試験は2018年にすべての症例の登録が無事終了した。
また、原子炉の検討結果を基に、適応拡大を目的とした臨床試験も実施されており、2019年から国立がん研究センターにて、悪性黒色腫と血管肉腫を対象に、加速器BNCTの第1相臨床試験が開始され,2022年11月には血管肉腫を対象に加速器BNCTの第2相臨床試験が開始されている。
これらの臨床試験に用いられた薬剤と加速器は2017年には厚生労働省の先駆けパッケージ戦略の1つに指定され、BNCT用ホウ素薬剤(一般名:ボロファラン(10B))と加速器を用いたBNCT治療システムのそれぞれについて、上記の臨床試験結果を基に製造販売承認申請が行われた。
そして2020年3月に、それぞれ「切除不能な局所進行又は局所再発の頭頸部癌」の適応で医療用医薬品および医療機器として厚生労働省から承認され、2020年6月には薬剤の薬価収載と医療機器の保険適用に至っている。
3. いかにしてホウ素をがん細胞に集めるか
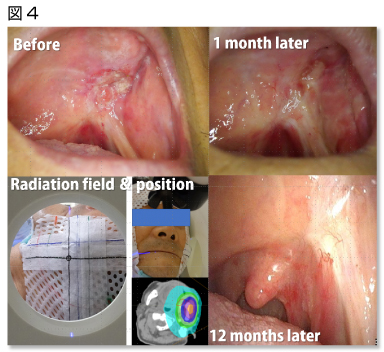
 これまでに、がん細胞へのホウ素キャリア-として臨床的に用いられてきたホウ素化合物は2種類である(図3)。
BSHはホウ素原子がカゴ型に配列した化合物で脳腫瘍の治療に用いられてきた。これは脳腫瘍では血液―脳関門が破壊されていることより正常脳細胞には集積しないBSHが、脳腫瘍に相対的に集積することを利用している。
脳腫瘍が能動的にBSHを取り込んでいるわけではない。 BPA(ボロファラン(10B))は必須アミノ酸のチロシンにホウ素原子が結合したものでがん細胞のアミノ酸取り込み亢進を利用したものである。
悪性黒色腫では、前述のアミノ酸取り込み亢進に加え、チロシンがメラニン合成の前駆物質であることから、他の腫瘍よりも高い集積性を認めている。
これまでに、がん細胞へのホウ素キャリア-として臨床的に用いられてきたホウ素化合物は2種類である(図3)。
BSHはホウ素原子がカゴ型に配列した化合物で脳腫瘍の治療に用いられてきた。これは脳腫瘍では血液―脳関門が破壊されていることより正常脳細胞には集積しないBSHが、脳腫瘍に相対的に集積することを利用している。
脳腫瘍が能動的にBSHを取り込んでいるわけではない。 BPA(ボロファラン(10B))は必須アミノ酸のチロシンにホウ素原子が結合したものでがん細胞のアミノ酸取り込み亢進を利用したものである。
悪性黒色腫では、前述のアミノ酸取り込み亢進に加え、チロシンがメラニン合成の前駆物質であることから、他の腫瘍よりも高い集積性を認めている。
4. ホウ素中性子捕捉療法の利点
・ 治療効果が予測できる事:BPAに18Fをラベルした化合物(18F-BPA)を用いてPET検査を行うことでがん病巣へのホウ素取り込み量を事前に把握できる(後述)。 このPET検査でがん組織/正常組織のホウ素濃度比が2.5以上あることを本治療実施の必須条件としている施設もある。 言い換えれば、2.5以上であれば効果が期待でき、2.5以下であれば本治療は行わない。治療前にその効果が予測できるということは、効果の期待できない無駄な治療で患者さんが苦しむこともなく、限りある医療資源の無駄遣いを減らす事にも繋がる。 治療前にその治療効果を数値として予測できるがん治療は現在のところ存在しない(がん組織/正常組織 のホウ素濃度比が大きければ大きいほど効果は期待できる)。
・ 照射範囲(治療範囲)が広く取れる事:従来の放射線治療では腫瘍の浸潤範囲と周辺正常組織の有害事象とのバランスの上に照射範囲を決定している。 一方、BNCTでは比較的広い照射野設定が可能でがん細胞を照射野外に逃がさなくてすむ。何故なら、照射範囲に含まれても正常細胞に取り込まれるホウ素量が少ないため、中性子照射により核分裂反応は生じないので正常組織はほとんどダメ-ジを受けないからである。 事実これまでの局所効果は、照射範囲に含まれた正常組織にほとんどダメ-ジを与えることなく治癒傾向を認めている。
・ 生物学的効果比が非常に高い事:ホウ素と熱中性子とリチウム原子核の核反応で生じるα粒子の飛程は極端に短く、その間に有している全運動エネルギ-を周囲に付与する(高LET放射線)。そのためX線照射が効くかどうかは腫瘍側の放射線感受性に大きく左右されるが、高LET放射線のα粒子は放射線感受性に左右されず、放射線抵抗性がんにも効果を発揮する。
・ 原則1回の照射で終了する事:手術、放射線治療、抗がん剤治療では、1~2ヶ月間の入院・外来治療が必要であるが、BNCTの実質治療期間は1日である。
5. 実際の治療症例
 (1)頭頸部がん
(1)頭頸部がん
頭頸部がんの標準治療は手術、X線治療、化学療法を併用して行われる。BNCTは正常組織線量を軽減して照射することが可能であるため、特に再発頭頸部がんに対する治療として期待されている。
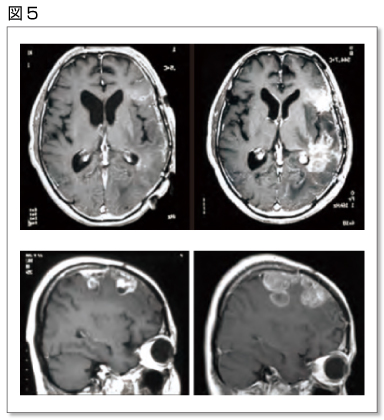
世界初の加速器BNCTシステムは切除不能な局所進行又は局所再発の頭頸部癌に対して保険適用された。再発頭頸部がんのBNCTの一例を右写真に示す(図4)。BNCTの12か月後に腫瘍は完全に縮退し、粘膜への重度な障害は認められなかった。(T. Aihara. et al., IAEA BNCT TECDOC, 218-220,2022、大阪医科薬科大学の症例写真-左上:BNCT前、右上:BNCT一か月後、左下:照射野と照射位置、右下:BNCT12か月後)
他の治療法では粘膜への障害を避けながら、直下にある腫瘍に対して十分な線量を付与することは困難であり、BNCTの腫瘍選択性の高さと優位性が示されている。
 (2) 脳腫瘍
(2) 脳腫瘍
BNCTの臨床では、悪性脳腫瘍、特に膠芽腫などの悪性神経膠腫の治療として大きな期待が寄せられている(図5)。BNCTは一度に大量の放射線を照射できるため、通常分割のX線治療と異なり、腫瘍の反応(MRIでの病変の縮小・消失)が非常に早い(2日程度)例もある(写真上:大阪医科薬科大学での症例、左:BNCT前、右:BNCT2日後)。
上記の例以外にも、悪性髄膜腫で良好な腫瘍の治療効果を示した症例がある。この腫瘍は通常のX線治療に対しては良い反応が得られにくい腫瘍である(写真下:大阪医科薬科大学の症例、左:BNCT前、右:BNCT1か月後)。
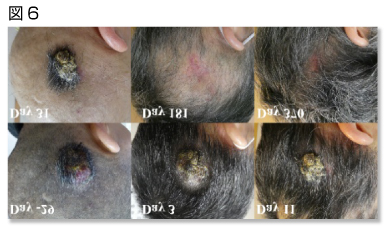 (3) 皮膚腫瘍
(3) 皮膚腫瘍
原子炉を用いたBNCTの臨床研究から、皮膚がんは有効なBNCTの適応疾患とされている。加速器を用いたBNCT(AB-BNCT)による皮膚がん(メラノーマと血管肉腫が対象疾患)を対象とした臨床研究でも有望な結果が報告されている。
具体的には、血管肉腫の症例ではBNCTによる顕著な腫瘍抑制が観察された(図6)。希少がんの一種であり進行が早く悪性度も高い血管肉腫は、治療による予後が悪く治療法が限られている。この血管肉腫の原発症例と局所再発症例においても、BNCTは治療による重篤な治療による有害事象を伴わずに腫瘍抑制効果を示した。(Igaki H, et al., Clin. Transl. Radiat. Oncol. 33: 128-133 (2022), photo: the case at National Cancer Center Hospital).
6. 今後の展望
2020年に切除不能な局所進行又は局所再発の頭頸部癌に対するBNCTが保険適用となっただけでなく、上述の通り悪性脳腫瘍や皮膚腫瘍に対しても保険適用拡大を目指した研究開発が進行している。その他にも、乳がん、肝臓がん、悪性中皮腫といった疾患、更には、BPAががん細胞に集積する機序に着目してBPAが集積するすべてのがんを対象としたBNCTの適応拡大を目指す基礎研究も行われている。新しい中性子照射装置の開発も世界中で進みつつあり、これからもBNCTの更なる発展、普及が予想される。また、本治療はホウ素薬剤によるところが大きく、BPAやBSHよりもさらに有効なホウ素薬剤が開発されれば、適応疾患拡大にも繋がり易い。近い将来、多くの悪性腫瘍に対する選択治療の1つとしてBNCTが世界中の基幹病院等で行われる様になることが期待される。